参比制剂一次性进口通关
2019-03-04
浏览: 1991
一、参比制剂选择原则
根据《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品,NMPA已列出参比制剂清单并向社会公布,供企业选择参比制剂时参考。
清单分为已在中国境内上市和未在中国境内上市两类。企业可按以下顺序选择其一作为参比制剂:
- 原研药品:进口原研药品、经审核确定的原研企业在中国境内生产上市的药品、未进口原研药品;
- 在原研企业停止生产的情况下,可选择美国、日本或欧盟获准上市并获得参比制剂地位的药品。
二、参比制剂需提交材料
仿制药一致性评价注册申请时,需提交以下证明参比制剂来源的资料:
- 购买凭证(购买发票,药店小票等);
- 产品包装(产品外包装);
- 说明书、标签、样品照片 (网络打印版不认可);
- 一次性进口批件;
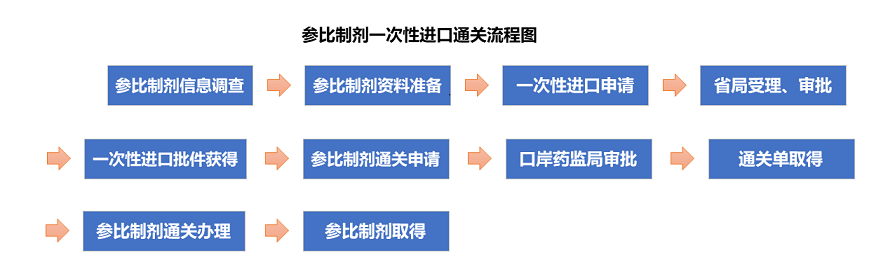
三、一次性进口批件申请所需材料
根据《总局关于研制过程中所需研究用对照药品一次性进口有关事宜的公告(2016年第120号) 》,办理参比制剂一次性进口批件时,需要提交以下材料:
- 《进口药品批件》申请表;
- 申请人机构合法登记证明文件复印件(如营业执照、组织机构代码证等);
- 一次性进口申请报告;
- 承诺书:申请人书面承诺所进口药品不得用于上市销售及申请用途以外的其他用途;
- 拟进口对照药品的国外获准上市证明材料(可提供上市国家药品监管部门核发的批准证明文件复印件、境外上市的药品说明书或上市国家药品监管部门网站公开信息等);(据调查,仅提供境外上市药品说明书-原件即可)
采购单位合法登记证明文件复印件(如营业执照、组织机构代码证等)
四、一次性进口通关所需材料
根据《总局关于研制过程中所需研究用对照药品一次性进口有关事宜的公告(2016年第120号) 》,办理参比制剂一次性进口批件时,需要提交以下材料:
申请人向口岸食品药品监督管理局提出申请办理《进口通关单》,并同时提供以下资料:
- 所进口药品的《进口药品批件》;
- 申请人机构合法登记证明文件复印件(如营业执照、组织机构代码证等)。属于委托申请的,另须提供委托人的合法登记证明文件复印件及委托证明文件;
- 原产地证明复印件(由外贸公司或者代理公司在原产国当地办理);
- 货物合同复印件;
- 装箱单、提运单和货运发票复印件;
- 药品说明书及包装、标签式样(原料药和制剂中间体除外);
经其他国家或者地区转口的进口药品,需要同时提交从原产地到各转口地的全部购货合同、装箱单、提运单和货运发票等。
相关案例
-
维奈托克获得优先审评2月10日CDE官网公示了纳入优先审评的维纳克拉片。根据《总局关于鼓励药品创新实行优先审评审批的意见食药监药化管〔2017〕126号》中规定,维纳克拉为防治下列疾病且具有明显临床优势的药品注册申请(4.罕见病;5.恶性肿瘤;)且为临床急需、市场短缺的药品注册申请。2020-02-26
-
格乐立(阿达木单抗)开展新型冠状病毒肺炎临床研究中国临床试验注册中心显示,百奥泰生物的阿达木单抗生物类似药格乐立登记了一项治疗新冠肺炎重型和危重型患者的安全性和有效性的临床研究,旨在比较在标准化治疗基础上,观察加/不加阿达木单抗治疗重型及危重型新冠肺炎的临床疗效和安全性。2020-02-26
-
国家药监局关于发布真实世界证据支持药物研发与审评的指导原则(试行)的通告(2020年第1号)为进一步指导和规范真实世界证据用于支持药物研发和审评的有关工作,保障药物研发工作质量和效率,国家药品监督管理局组织制定了《真实世界证据支持药物研发与审评的指导原则(试行)》,现予发布。2020-01-08
-
重大通知!遗传办发布简化审批流程通知!为深化 “放管服”改革,缩短行政审批时间,经研究决定对部分行政审批项目实施简化审批流程2020-01-07
-
重大通知!遗传办发布简化审批流程通知!为深化 “放管服”改革,缩短行政审批时间,经研究决定对部分行政审批项目实施简化审批流程。2020-01-07


