原辅包备案
2019-03-04
浏览: 2171
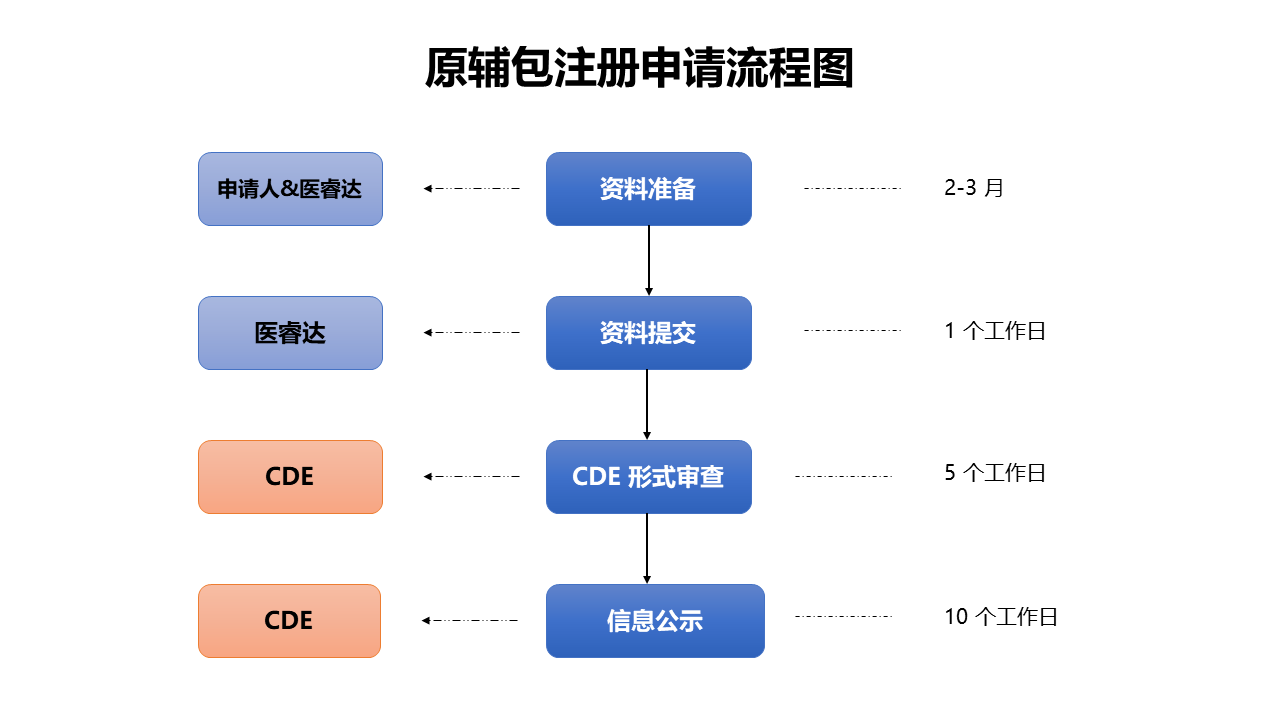
根据总局关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号),药品注册申请人在中华人民共和国境内提出的注册分类2.2、2.3、2.4、3、4、5类药品制剂申请所使用的原料药,以及各类药品注册申请所使用的药用辅料、药包材均需提交备案申请。
- 原料药登记资料主要内容:基本信息、生产信息、特性鉴定、原料药的质量控制、对照品、药包材、稳定性等。具体内容应当符合《关于发布化学药品新注册分类申报资料要求(试行)的通告》(国家食品药品监督管理总局通告2016年第80号)中原料药药学申报资料要求。
- 药用辅料登记资料主要内容:企业基本信息、辅料基本信息、生产信息、特性鉴定、质量控制、批检验报告、稳定性研究、药理毒理研究等。具体内容应当符合《关于发布药包材药用辅料申报资料要求(试行)的通告》(国家食品药品监督管理总局通告2016年第155号)中药用辅料申报资料要求。
- 药包材登记资料主要内容:企业基本信息、药包材基本信息、生产信息、质量控制、批检验报告、稳定性研究、安全性和相容性研究等。具体内容应当符合2016年第155号通告中药包材申报资料要求。
药品制剂申请人仅供自用的原料药、药用辅料和药包材,或者专供特定药品上市许可持有人使用的原料药、药用辅料和药包材,可在药品制剂申请中同时提交原料药、药用辅料和药包材资料(资料要求参照本公告执行),不进行登记。
相关案例
-
沟通交流会议申请国家药品监督管理局关于发布药物研发与技术审评沟通交流管理办法的公告(2018年第74号) 1. 适用范围 适用于创新药物、改良型新药、生物类似药、复杂仿制药以及一致性评价品种等研发过程和注册申请中的沟通交流。 2. 会议形式 面对面会议;视频会议、电话会议或书面回复。2019-03-04
-
药械组合注册战略根据国家食品药品监督管理局发布的《关于药械组合产品注册有关事宜的通告》2009年底16号》中规定: 一、药械组合产品系指由药品与医疗器械共同组成,并作为一个单一实体生产的产品。 二、以药品作用为主的药械组合产品,需申报药品注册;以医疗器械作用为主的药械组合产品,需申报医疗器械注册。2019-03-04


